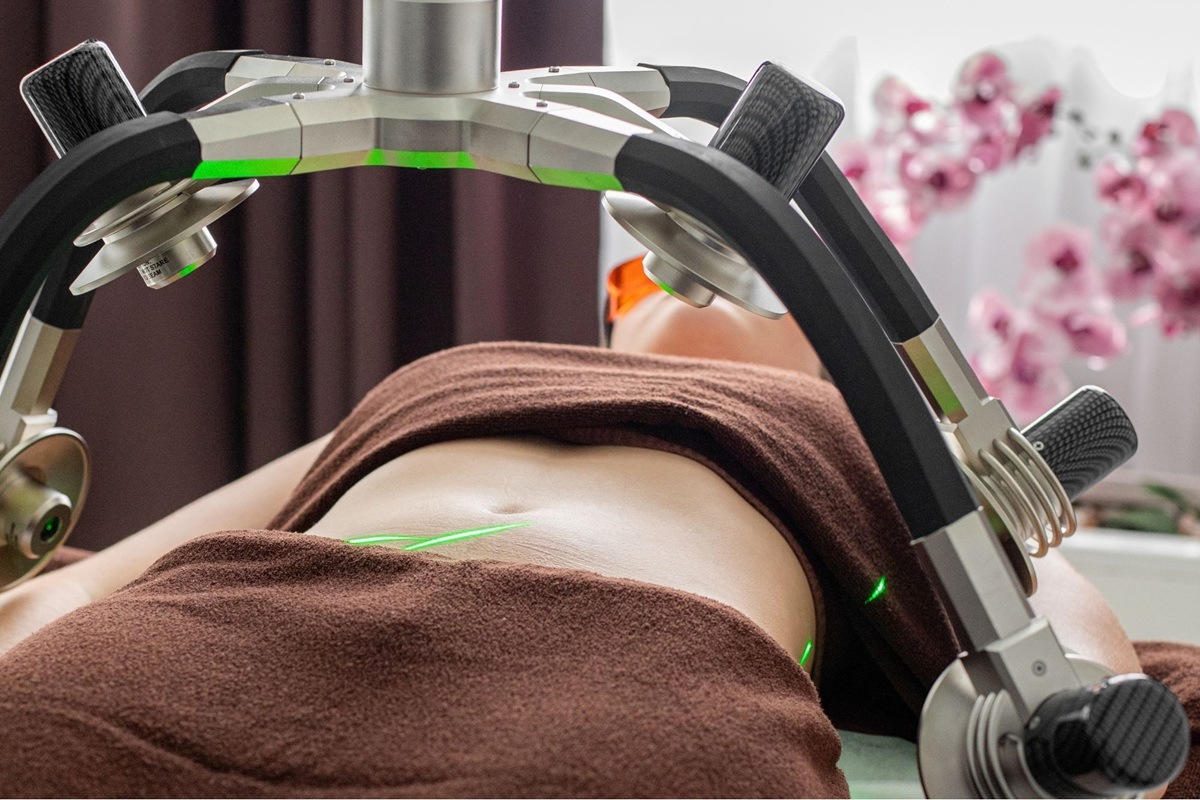
L’Administration nationale des médicaments, des aliments et des technologies médicales (ANMAT) a interdit immédiatement l’utilisation, la commercialisation, la publication et la distribution dans tout le pays des équipements médicaux identifiés comme Dermotherap, modèles AQUA et SIENNA, fabriqués par DERMOEQUIPOS SRL, après avoir constaté que ces dispositifs ne disposaient pas d’enregistrement sanitaire et présentaient des risques pour la santé publique.
Choc dans une clinique esthétique : un médecin surpris en train d’utiliser du matériel dangereux
Selon le récit, la décision fait suite à une inspection effectuée dans un cabinet médical situé au 2500 Mansilla, dans la ville autonome de Buenos Aires (CABA), où le personnel du Département de contrôle du marché, en collaboration avec des agents de la Division des délits contre la santé de la police de la ville, a agi sur ordre du parquet de première instance en matière pénale, contraventionnelle et délictuelle n° 21.
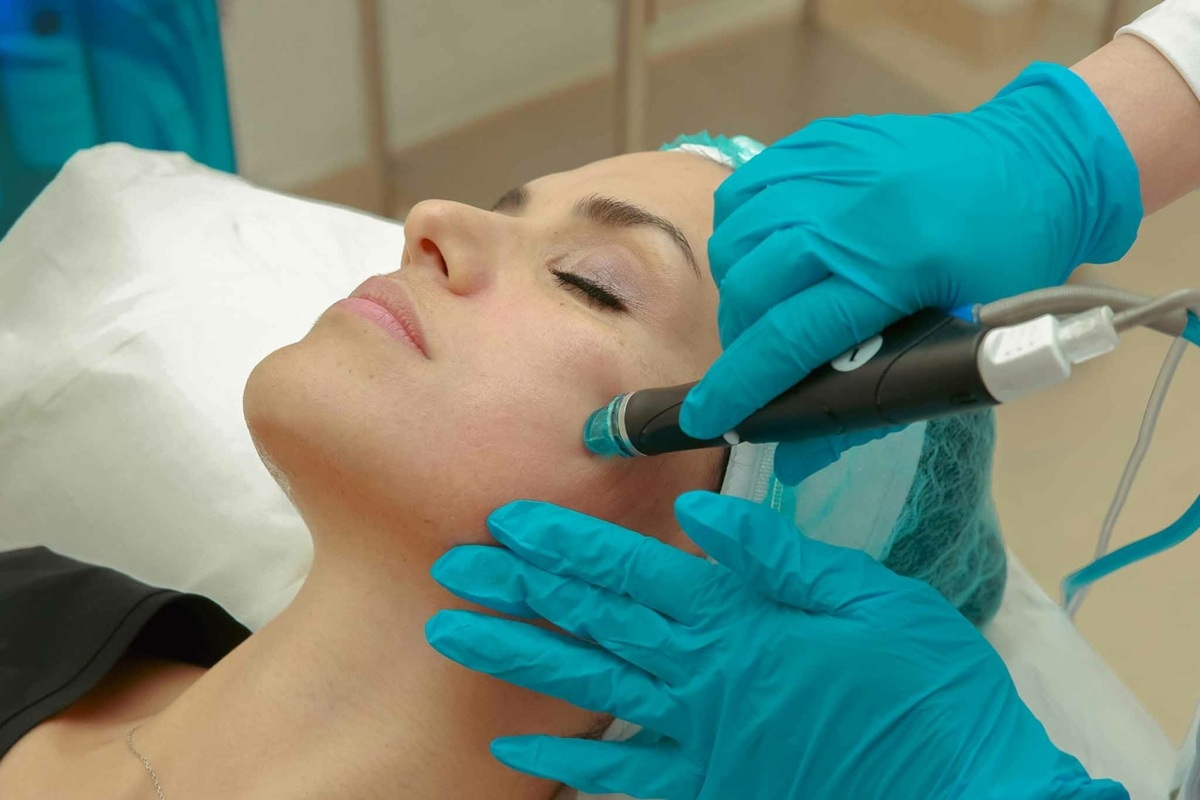
Sur place, un homme qui s’est identifié comme médecin, identifié comme G. R., a admis qu’il utilisait l’appartement pour soigner des patients et réaliser des interventions esthétiques, telles que des soins postopératoires, des traitements du visage et du corps, l’application de toxine botulique, d’acide hyaluronique et de mésothérapie.
Au cours de l’inspection, la présence de plusieurs cabinets aménagés en salles de consultation a été constatée et deux appareils portant la mention « Dermotherap », modèles AQUA et SIENNA, ont été trouvés, tous deux sans données d’enregistrement sanitaire ni date de fabrication visible.
Le propriétaire du bâtiment, identifié comme G. S. M., a reconnu que le lieu ne disposait pas d’autorisation sanitaire. Interrogé par les inspecteurs, G. R. n’a pas été en mesure de présenter les documents attestant de la provenance des équipements, mais il a ensuite envoyé une facture de 2013 émise par DERMOEQUIPOS SRL. Cependant, l’enquête a déterminé que la date de fabrication des appareils était postérieure à celle de la facture présentée, ce qui a suscité des doutes quant à la traçabilité et la légalité des produits.
L’ANMAT a vérifié dans son système d’enregistrement que les équipements n’étaient pas répertoriés comme autorisés. Après avoir consulté le fabricant, le personnel de DERMOEQUIPOS SRL a admis que les modèles AQUA et SIENNA avaient été fabriqués par l’entreprise, mais que l’enregistrement sanitaire correspondant n’avait jamais été effectué. En outre, l’entreprise a indiqué que la production de ces équipements avait été interrompue en janvier 2025, bien qu’ils aient été commercialisés en 2024, et a fourni des factures de vente à différents particuliers pour cette période.
Ainsi, le département de contrôle du marché de l’ANMAT a signalé qu’il existe des produits similaires dûment enregistrés, tels que le PM 1088-36, indiqué pour le traitement de la cellulite et de l’adiposité localisée, et le PM 1090-51, destiné au rajeunissement et à la tonification du visage, tous deux classés dans la catégorie de risque II. Cependant, les appareils AQUA et SIENNA ne sont pas enregistrés, de sorte que leurs caractéristiques, leur fonctionnalité et leur sécurité sont inconnues, ce qui représente un risque pour la santé des utilisateurs.
Selon l’organisme, « les caractéristiques, la fonctionnalité et la sécurité des appareils sont inconnues, ils présentent un risque pour la santé ; et comme il pourrait exister d’autres produits identiques en cours de commercialisation ou d’utilisation, afin de protéger les acheteurs et utilisateurs potentiels des produits concernés », une interdiction préventive a été recommandée.
La disposition ordonne également l’ouverture d’une enquête sanitaire contre DERMOEQUIPOS SRL et son directeur technique, pour violation présumée des articles 2 et 19 de la loi n° 16.463, qui interdit la fabrication, la détention, le fractionnement, la circulation, la distribution et la livraison au public de produits impurs ou illégitimes, et aux paragraphes 1 des parties 1 et 3 de l’annexe de la disposition ANMAT n° 64/25, qui établit l’obligation d’enregistrer tous les produits médicaux sur le territoire national.
« L’enregistrement de tous les produits médicaux inclus dans ce RTM est obligatoire. On entend par enregistrement la procédure administrative par laquelle chaque État partie autorise la commercialisation d’un produit médical sur son territoire national », ont-ils justifié.